はじめに:体内の微細構造を視るための技術的挑戦
医療診断の最前線では、生体組織の内部を非侵襲かつ高解像度で観察する技術が、疾患の早期発見や精密な治療において極めて重要な役割を担っています 1。特に、光コヒーレンストモグラフィ(OCT)は、「光を用いた超音波検査」とも称される画期的なイメージング技術です。近赤外光の干渉を利用して、組織の断層画像をマイクロメートル単位の分解能で取得できるため、眼科領域の網膜診断から循環器内科における血管内プラークの評価まで、幅広い分野で不可欠なツールとなっています 3。
OCTで2次元や3次元の画像を得るには、光ビームを試料上で精密に走査(スキャン)する機構が必須です。しかし、このスキャン機構が、特にカテーテルや内視鏡のような小型デバイスへの応用の際に大きな技術的ボトルネックとなっていました。従来主流であったMEMS(Micro-Electro-Mechanical Systems)ミラーは、小型化には成功したものの、性能面で深刻なトレードオフを抱えています。
この記事では、コロラド大学ボルダー校の研究チームが発表した画期的な論文 5 に基づき、この長年の課題を解決する可能性を秘めた新技術、「エレクトロウェッティング」を用いた非機械式ビームスキャナを詳細に解説します。固体部品の機械的な動きに頼らず、「液体」の界面を電気的に制御することで光を操るこのアプローチは、OCTシステムの設計思想を根本から変えるかもしれません。本稿を通じて、その技術的革新性、実証された性能、そして未来の医療イメージングに与えるインパクトを深く理解することができるでしょう。
論文の核心:画質を犠牲にしない非機械式スキャンの実証
今回取り上げる論文「Nonmechanical spectral domain optical coherence tomography using an electrowetting beam-scanner」5 の技術的な核心は、
世界で初めてエレクトロウェッティング(EWOD)プリズムを光ビームのラテラルスキャンに応用し、高性能なスペクトルドメインOCT(SD-OCT)システムにおいて、画質の主要指標である軸分解能や感度を損なうことなく、断層画像の取得に成功した点にあります。
研究チームは、独自に開発した直径4 mmのエレクトロウェッティングプリズムを、最先端の光源を備えたベンチトップOCTシステムに統合しました。そして、ダイヤモンド研磨ペーストや3Dプリントされたターゲット、さらには生物試料であるゼブラフィッシュの眼といった多様なサンプルのイメージングを実施。その結果、この液体スキャナが、従来の機械式スキャナに匹敵する鮮明な画像を生成できることを実証しました。これは、エレクトロウェッティング技術が単なる基礎研究の域を超え、実用的なイメージングデバイスのキーコンポーネントとなり得ることを示す、重要な概念実証(Proof-of-Concept)です。
詳細な技術解説
OCTの基本原理とスペクトルドメイン方式の優位性
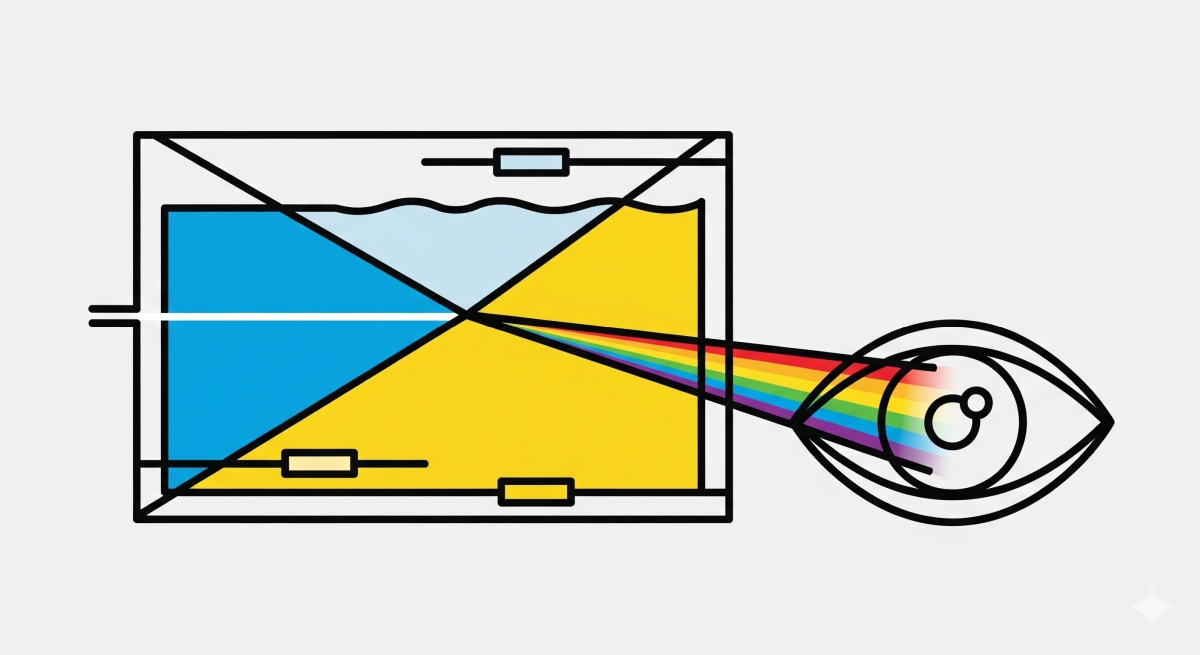
OCTの原理を理解する鍵は「光の干渉」にあります 2。まず、広帯域(低コヒーレンス)の光源からの光を、参照アームとサンプルアームの二つに分割します。サンプルアームの光は生体組織に照射され、内部の様々な深さの界面から反射・散乱して戻ってきます。この戻り光と、参照アームからの光を再び合波させると、両者の光路長がほぼ等しい場合にのみ、特有の干渉縞が生成されます 7。この干渉現象を利用することで、組織内部のどの深さから光が反射してきたかを、極めて高い精度で特定できるのです。これを深さ方向のスキャン(A-スキャン)と呼びます 8。
初期のタイムドメインOCT(TD-OCT)は、参照アームのミラーを物理的に動かすことで光路長を変化させ、各深さの情報を順次取得していました 9。しかしこの方式は、機械的な動作速度に限界があり、高速なイメージングには不向きでした。
この問題を解決したのが、現在主流となっているスペクトルドメインOCT(SD-OCT)です 4。SD-OCTでは、参照ミラーを固定したまま、サンプルからの戻り光と参照光が干渉した光を分光器(スペクトロメータ)で波長ごとに分離します。得られたスペクトル干渉信号には、サンプルの全ての深さ情報が一度にエンコードされています。この信号をコンピュータでフーリエ変換することで、瞬時にA-スキャンを再構成できるのです 8。このアーキテクチャの転換により、SD-OCTはTD-OCTに比べて感度と撮像速度が飛躍的に向上し、リアルタイムでの3Dイメージングを可能にしました。
内視鏡OCTにおける「スキャンのジレンマ」
OCTを内視鏡のような細径プローブに応用するには、ビームスキャナを極限まで小型化する必要があります。その要求に応える技術として、MEMSミラーが広く用いられてきました 5。しかし、MEMSミラーには、その駆動原理に起因する根深い「ジレンマ」が存在します。
- 静電駆動MEMS: 電極間の静電力でミラーを駆動するタイプです。非常に高速(数kHz)なスキャンが可能で、リアルタイムイメージングに適しています。しかし、その駆動には数百ボルトという高電圧が必要となり、体内で使用する医療機器としては安全性の懸念が大きな課題となります 5。
- 熱駆動MEMS: 抵抗加熱による材料の熱膨張を利用してミラーを駆動します。数ボルトという安全な低電圧で動作する利点がありますが、加熱・冷却の応答が遅いため、スキャン速度が遅く、生体内での動きによるモーションアーチファクト(画像のブレ)が発生しやすいという致命的な欠点を抱えています 5。
このように、既存のMEMS技術では「速度」と「安全性(低電圧)」がトレードオフの関係にあり、どちらかを優先すればもう一方が犠牲になるという状況が続いていました。このジレンマが、高性能な前方観察型OCT内視鏡の開発を阻む一因となっていたのです。
新たな潮流「エレクトロウェッティング」技術
このMEMSのジレンマを根本的に解決するアプローチとして、Gilinskyらの研究チームが着目したのが「エレクトロウェッティング」です。
EWODの原理
エレクトロウェッティング・オン・誘電体(Electrowetting-on-Dielectric, EWOD)とは、誘電体膜で覆われた電極上の導電性液滴に電圧を印加することで、液滴の濡れ性(接触角)を変化させる現象です 10。具体的には、電圧をかけると液滴と電極間の界面エネルギーが変化し、疎水性の表面が親水性のようになり、液滴が表面に広がるように接触角が小さくなります。
この現象の最大の特徴は、固体部品の機械的な動きを一切伴わない点です。また、静電容量効果を利用するため、状態を維持するのにほとんど電力を消費せず、極めて低消費電力なアクチュエーションが可能です 12。これらの特性から、これまで電子ペーパーやマイクロ流体デバイスなどに応用されてきました 13。
液体プリズムスキャナの構造と性能
研究チームは、このEWODの原理を巧みに応用し、光ビームを操る「液体プリズム」を開発しました 5。
その構造は、円筒形のガラス容器に、互いに混ざり合わない2種類の液体(導電性の脱イオン水と非導電性のオイルである1-フェニル-1-シクロヘキセン)を満たしたものです。これらの液体は、屈折率が大きく異なる一方で、密度がほぼ等しくなるように選ばれており、これにより重力や振動の影響を受けにくくなっています。
容器の内壁には4つの独立した電極が配置されています。全ての電極に同じバイアス電圧(67 V)をかけると、液体間の界面は平坦になります。ここから、対向する電極間に差動電圧(最大 ±20 V)を印加すると、それぞれの電極位置で接触角が変化し、液体界面が傾きます。屈折率の異なる液体界面が傾くことで、そこを透過する光はプリズムと同様に屈折し、進行方向が変わります。この傾きを電気的に高速制御することで、ビームスキャンを実現するのです。
このデバイスは、最大で ±6° の光学的スキャン角度を達成しました。これは、一部のMEMSミラーに匹敵する性能です。
実証システムの性能と成果
この液体プリズムスキャナが、実際のOCTシステムにおいて有効に機能するかを検証することが、本研究の最も重要な部分です。
画質を犠牲にしないスキャン性能
研究の最大の成果は、エレクトロウェッティングプリズムをシステムに組み込んでも、OCTの根幹をなす性能が低下しなかったことです 5。実測された軸分解能は空中換算で 12.8 µm(生体組織内では約 9 µm に相当)であり、これは使用した広帯域光源の理論限界に近い値です。また、システムの感度は 110 dB を達成しており、これは最先端のOCTシステムに求められる高水準を満たしています。
この結果は、開発された液体プリズムが、光の損失や波面の乱れ(収差)をほとんど引き起こさない、極めて高い光学品質を持つことを示しています。これにより、低消費電力や堅牢性といったエレクトロウェッティングの利点を、画質を犠牲にすることなく享受できることが証明されました。
潜在的な課題:分散の影響
一方で、ミラーのような反射型素子と異なり、液体プリズムは光が物質内を透過する「透過型」素子であるため、特有の課題も存在します。それが「分散」です 5。
- 時間的分散(色分散): 光の波長によって液体中の進行速度が異なるため、広帯域の光パルスが時間的に広がってしまう現象です。これはOCTの軸分解能を劣化させる要因となりますが、論文ではその影響が標準的なレンズ2枚分程度であり、後処理のデジタル補正で十分対応可能であることが示されています。
- 空間的分散: 波長によって屈折角度がわずかに異なるため、ビームが虹のように空間的に分離してしまう現象です。これにより、焦点でのスポットが滲み、横分解能が低下する可能性があります。論文の分析によれば、この影響はスキャナから数ミリメートルの距離で顕在化し始めるため、スキャナと後続のレンズを近接して配置するといった光学設計上の工夫が必要になることが示唆されています。
生体組織イメージングへの応用
最終的な性能実証として、研究チームはゼブラフィッシュの眼のイメージングを行いました 5。取得された断層画像では、角膜や虹彩といった微細な組織構造が明瞭に描出されており、このシステムが複雑な生物試料の観察にも十分耐えうる能力を持つことが示されました。これは、本技術が将来的に臨床応用へと繋がる大きな一歩と言えます。
まとめと今後の展望
本稿で解説したGilinskyらの研究は、エレクトロウェッティングという流体制御技術を用いて、高性能OCTシステムの非機械式ビームスキャンを世界で初めて成功させた、画期的な成果です。その最大の意義は、MEMSミラーが抱えていた「速度と安全性のジレンマ」を回避し、低消費電力、機械的な堅牢性、シンプルな光学系という新たな価値をOCTシステムにもたらす道筋を示した点にあります。
もちろん、臨床応用に向けたいくつかの課題は残されています。今回実証された直径4 mmのデバイスの応答速度(約100 ms)は、リアルタイムイメージングにはまだ不十分です。また、駆動電圧も、体内での使用基準(一般的に 40 V 未満)よりは高い値です。
しかし、論文ではこれらの課題に対する明確な解決策が提示されています 5。応答速度は、デバイスを小型化することで劇的に向上します(直径 500 µm で 1.5 ms 未満が期待できる)。駆動電圧も、誘電体膜の材料やデバイス構造の最適化により、10 V 以下にまで低減できる可能性が示されています。
この技術が成熟すれば、安全で高性能な前方観察型OCT内視鏡が実現し、消化器がんの早期発見や動脈硬化プラークの性状診断などに革命をもたらすかもしれません。さらにその応用範囲は医療分野に留まらず、その低消費電力性と堅牢性から、携帯型の診断装置や、ロボット・ドローンに搭載される小型LiDARなど、次世代のコンパクトイメージングシステム全般におけるキーテクノロジーとなる大きな可能性を秘めています。エレクトロウェッティングは、まさにイメージング技術の未来を切り拓く、静かで力強い潮流となりつつあるのです。

コメント